mOS达64.8个月,5年OS率52.3%!特瑞普利单抗联合化疗一线治疗R/M NPC刷新长生存记录
2025 ESMO Asia
作为首个确证生存获益的鼻咽癌免疫一线治疗临床研究,JUPITER-02研究为国际免疫治疗领域贡献了中国方案。目前,特瑞普利单抗联合GP化疗一线治疗R/M NPC已在全球40多个国家和地区获得批准上市,并同时获得国内外三大权威指南(CSCO、NCCN、ESMO)推荐,引领全球R/M NPC一线治疗新标准。
研究共纳入289例未接受过化疗的RM-NPC患者,随机(1:1)接受特瑞普利单抗240mg (n=146)或安慰剂(n=143)联合吉西他滨和顺铂(GP)化疗(Q3W,最多6周期),随后接受特瑞普利单抗或安慰剂单药治疗(Q3W),直至疾病进展、出现不可耐受毒性或完成2年治疗。分层因素包括入组时的ECOG体能状况评分(0 vs. 1)和疾病程度(复发 vs. 原发转移)。研究主要终点为盲态独立评审委员会(BIRC)根据RECIST v1.1标准评估的意向性治疗(ITT)人群的无进展生存期(PFS),次要终点包括OS(关键次要终点)、研究者评估的PFS、客观缓解率(ORR)和安全性等。
mOS达64.8个月,特瑞普利单抗联合化疗刷新一线R/M NPC长生存记录
此前,该研究按照方案规定,在进行OS最终分析后已完成。最终OS分析结果(截止日期为2022年11月18日)显示,与单纯化疗相比,特瑞普利单抗联合GP化疗一线治疗R/M NPC可显著延长OS,具有统计学意义和临床意义的生存获益。中位OS分别为尚未达到 vs. 33.7个月,HR=0.63(95% CI: 0.45-0.89; P=0.008),3年OS率达64.5%。
之后,仍存活的患者重新知情同意参与长期生存随访。截至2025年6月24日,与OS最终分析结果相比,特瑞普利单抗组表现出一致的显著生存改善:
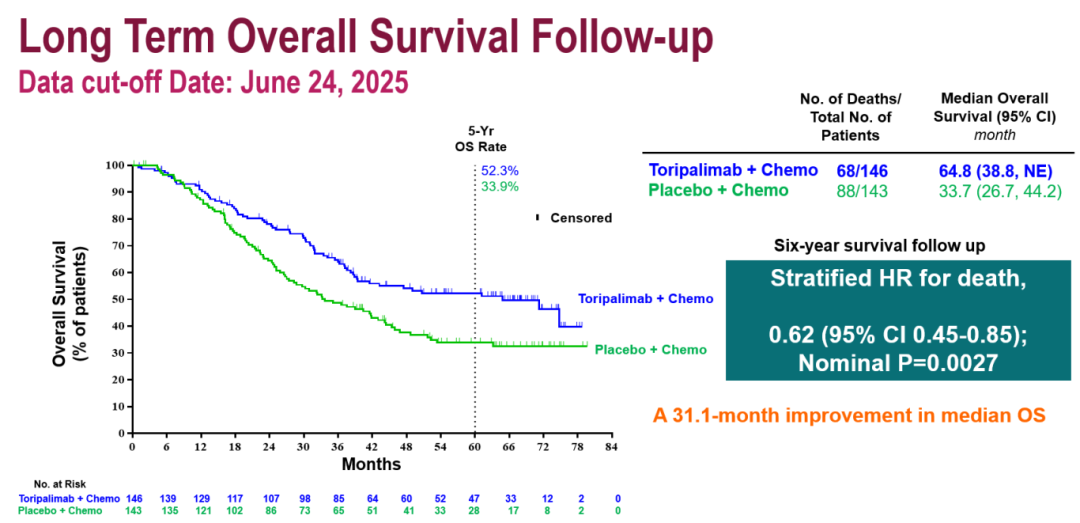
特瑞普利单抗组中位OS为64.8个月,而安慰剂组为33.7个月,特瑞普利单抗联合GP化疗将中位OS延长了31.1个月,死亡风险降低39%(HR=0.62;95%CI: 0.45-0.85),P=0.0027。5年OS率分别为52.3% vs. 33.9%(图1)。
图1. JUPITER-02研究长期生存随访分析
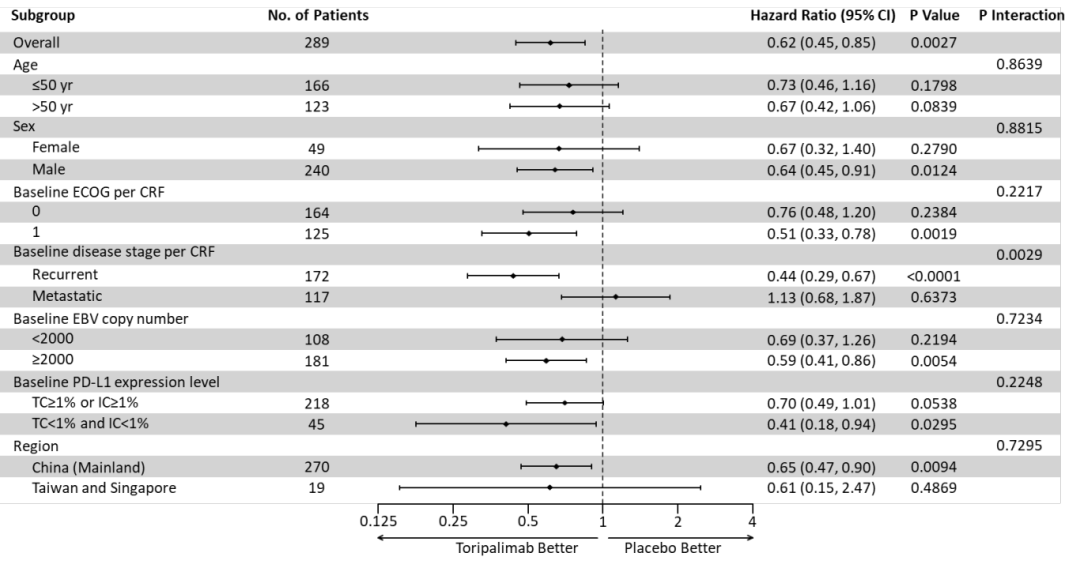
关键亚组分析显示,几乎所有亚组中均观察到特瑞普利单抗组的OS改善。其中PD-L1 表达亚组分析显示,无论PD-L1表达状态如何,特瑞普利单抗组OS均得到改善。
图2. OS亚组分析
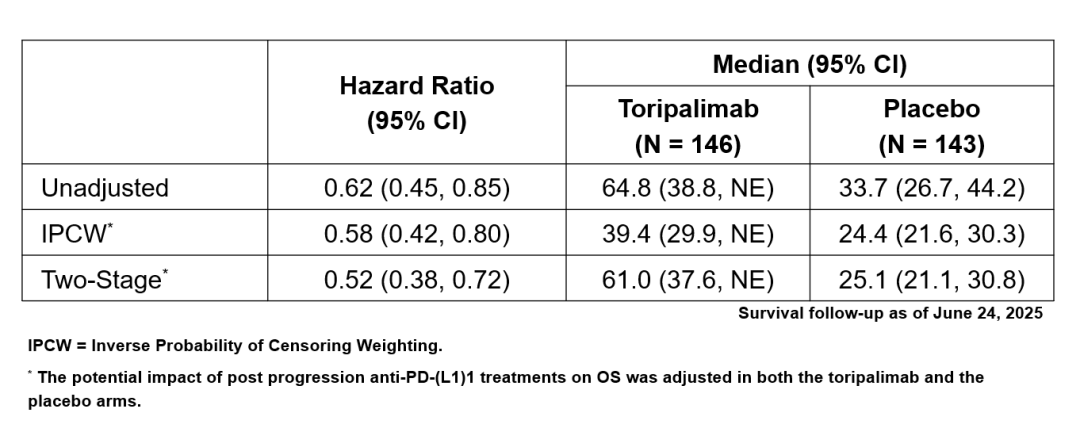
发生疾病进展的患者中,43%的患者接受了后线免疫治疗。为进一步评估进展后免疫治疗对生存的影响,研究者进行敏感性分析。在意向性治疗(ITT)人群中,对于进展后接受抗PD-(L)1治疗的情况进行调整后,特瑞普利单抗组与安慰剂组的中位OS分别为61.0 vs. 25.1个月,HR=0.52(95% CI: 0.38-0.72),风险比明显优于调整前的结果。该结果表明排除后线免疫治疗的影响,特瑞普利单抗组的OS获益趋势更明显。
表1. 校正疾病进展后抗PD-(L)1治疗影响的OS敏感性分析
综上,特瑞普利单抗联合GP化疗一线治疗R/M NPC,具有显著临床和统计学意义的长期生存获益,中位OS达64.8个月,相较于单纯化疗延长了31.1个月,引领R/M NPC一线治疗新标准。
内容来源:ESMO Asia官网
1. 本材料旨在传递前沿信息,无意向您做任何产品的推广,不作为临床用药指导。
2. 若您想了解具体疾病诊疗信息,请遵从医疗卫生专业人士的意见与指导。
关于特瑞普利单抗注射液(拓益 )
特瑞普利单抗注射液(拓益 )作为我国批准上市的首个国产以PD-1为靶点的单抗药物,获得国家科技重大专项项目支持,并荣膺国家专利领域最高奖项“中国专利金奖”。
特瑞普利单抗至今已在全球(包括中国、美国、欧洲及东南亚等地)开展了覆盖超过15个适应症的40多项由公司发起的临床研究。正在进行或已完成的关键注册临床研究在多个瘤种范围内评估特瑞普利单抗的安全性及疗效,包括肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、肾癌及皮肤癌等。
截至目前,特瑞普利单抗已在中国内地获批12项适应症:【1】用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗(2018年12月);【2】用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌患者的治疗(2021年2月);【3】用于含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌的治疗(2021年4月);【4】联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗(2021年11月);【5】联合紫杉醇和顺铂用于不可切除局部晚期/复发或远处转移性食管鳞癌患者的一线治疗(2022年5月);【6】联合培美曲塞和铂类用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌的一线治疗(2022年9月);【7】联合化疗围手术期治疗,继之本品单药作为辅助治疗,用于可切除IIIA-IIIB期非小细胞肺癌的成人患者(2023年12月);【8】联合阿昔替尼用于中高危的不可切除或转移性肾细胞癌患者的一线治疗(2024年4月);【9】联合依托泊苷和铂类用于广泛期小细胞肺癌一线治疗(2024年6月);【10】联合注射用紫杉醇(白蛋白结合型)用于经充分验证的检测评估PD-L1阳性(CPS≥1)的复发或转移性三阴性乳腺癌的一线治疗(2024年6月);【11】联合贝伐珠单抗用于不可切除或转移性肝细胞癌患者的一线治疗(2025年3月);【12】用于不可切除或转移性黑色素瘤的一线治疗(2025年4月)。2020年12月,特瑞普利单抗首次通过国家医保谈判,目前12项获批适应症已全部纳入《国家医保目录(2025年)》,是目录中唯一用于黑色素瘤、肾癌、三阴性乳腺癌治疗的抗PD-1单抗药物。特瑞普利单抗用于晚期鼻咽癌和食管鳞癌治疗的3项适应症已在中国香港获批。
在国际化布局方面,特瑞普利单抗目前已在美国、欧盟、印度、英国、约旦、澳大利亚、新加坡、阿联酋、科威特、巴基斯坦、加拿大等国家和地区获得批准上市,并在全球多个国家和地区接受上市审评。
关于君实生物
君实生物(688180.SH,1877.HK)成立于2012年12月,是一家以创新为驱动,致力于创新疗法的发现、开发和商业化的生物制药公司。依托全球一体化源头创新研发能力,公司已构建起涵盖超过50款创新药物的多层次产品管线,覆盖恶性肿瘤、自身免疫、慢性代谢类、神经系统、感染性疾病五大治疗领域,已有5款产品在国内或海外上市,包括我国首个自主研发、在中美欧等地超过40个国家和地区获批上市的PD-1抑制剂特瑞普利单抗(拓益 )。疫情期间,君实生物还参与开发了埃特司韦单抗、民得维 等多款预防和治疗新冠的创新药物,积极承担本土创新药企的责任。
君实生物以“用世界一流、值得信赖的创新药普惠患者”为使命,立足中国,布局全球。目前,公司在全球拥有约2500名员工,分布在美国马里兰,中国上海、苏州、北京、广州等。
0人