药物也能“精准导航”,新一代偶联技术如何提升精准医学 | Bilingual
编者按:在新一代精准治疗浪潮中,偶联药物凭借独特的分子设计理念,正成为精准治疗的重要模式。作为一种新兴的治疗模式,偶联药物通过将高选择性的靶向载体与高效药物载荷结合,实现了“精准递送、靶向释放”的目标。近年来,随着靶向载体的选择、偶联技术及有效载荷类型的不断丰富,偶联药物在癌症、感染、自身免疫及代谢疾病等多个领域展现出广阔的应用前景。本文将聚焦偶联药物中的连接子和药物载荷部分的结构和功能,并展示药明康德(603259)旗下WuXi TIDES一体化平台如何助力合作伙伴加速偶联药物开发。
偶联药物的设计理念基于“精准递送”的治疗思路。它通常包括三个核心部分:识别靶点的靶向分子、连接子(linker)以及药物载荷(payload)。三者协同作用,实现疾病部位的高效识别、稳定运输与载荷的选择性释放,从而显著提升治疗指数,并降低全身毒性。目前,全球已有多款使用单克隆抗体和多肽作为靶向分子的偶联药物获批上市,近年来,基于小分子或寡核苷酸作为靶向配体的新一代偶联药物也在快速发展。靶向分子之外,连接子和载荷的设计近年来也呈现出多样化趋势。
▲不同偶联药物类型(图片来源:参考资料[4])
连接子:控制载荷释放与稳定性的“分子桥梁”
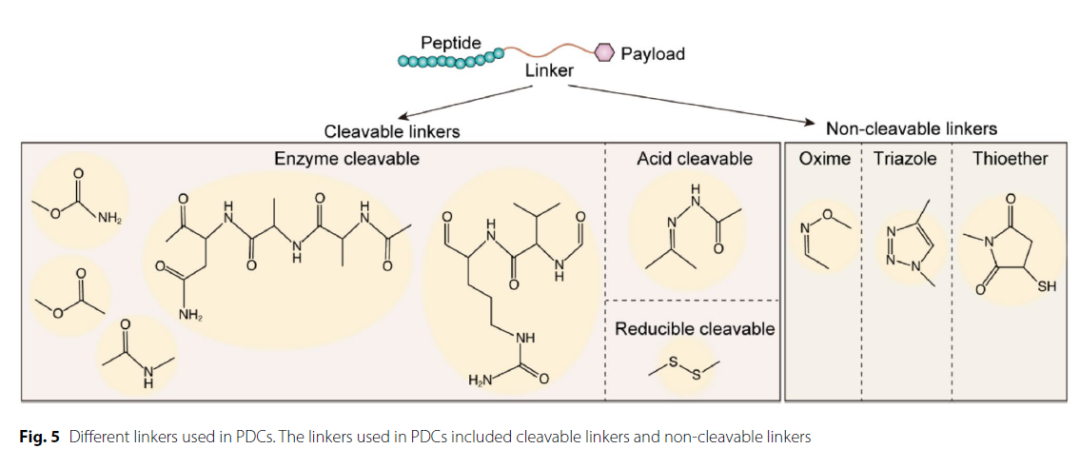
连接子是靶向载体与载荷之间的“桥梁”,在药物的体内稳定性和活性释放中起到决定性作用。理想的连接子应在血液循环中保持稳定,而在特定条件(如pH变化、特定蛋白酶或还原环境)下被精准切断,从而释放活性药物。
连接子主要分为可裂解型和不可裂解型两大类。可裂解型连接子又可依据裂解条件细分为酸可裂解型、酶可裂解型和还原可裂解型等多种类型。
▲不同类型的连接子(图片来源:参考资料[2])
不可裂解型连接子在血液循环中的稳定性高,脱靶效应较低。药物释放需要依靠细胞将偶联药物内吞到细胞内部,依赖细胞内蛋白质降解过程。然而,这种连接子构建的偶联药物可能在连接子断裂之前,药物的其他结构先发生裂解,从而产生非预期代谢物。
酸可裂解型连接子主要有腙和碳酸酯这两种结构,它们在酸性肿瘤微环境或细胞内体、溶酶体中被裂解,而在中性的血液循环中保持相对稳定。这种类型的连接子可以促进载荷在酸性肿瘤微环境中的释放,但是它们在血浆中的稳定性不高,可能导致载荷过早释放而产生毒副作用。
肿瘤微环境中的谷胱甘肽(GSH)水平是正常细胞的4倍,这有利于调控由可还原的二硫键连接的载荷在肿瘤微环境中的可控释放。
酶可裂解型连接子可被肿瘤微环境或溶酶体中高度表达的特定酶选择性降解,例如基质金属蛋白酶(MMP)和组织蛋白酶B。有些蛋白酶在细胞外或血液循环中没有活性,这意味着基于这类连接子的偶联药物在血液循环中能够保持稳定。
连接子的优化设计直接影响偶联药物的体内半衰期、靶向选择性及药效持续时间,是平衡疗效与安全性的关键环节。选择连接子时需要考虑因素包括:连接子是否易于与靶向配体和载荷进行连接,并且不影响配体对其受体的亲和力;连接子的性质对偶联的载荷本身理化属性的影响;以及与有效载荷的偶联位点能否保证载荷的有效和特异性释放等等。
药物载荷:决定疗效的“战斗单元”
药物载荷是偶联的核心功能单元,通常为具有高效细胞毒性或生物活性的分子,用于在靶点处发挥治疗作用。根据治疗目的不同,偶联药物可搭载多种类型的载荷,其中包括:
细胞毒性药物:包括紫杉醇衍生物、拓扑异构酶抑制剂,微管抑制剂等药物类型,主要用于治疗癌症。
放射性同位素:可通过与靶向配体偶联,形成具有治疗作用的靶向药物或者用于癌症诊断的成像试剂。例如,Ga-68 DOTATOC由放射性同位素镓-68和生长抑素类似物DOTATOC偶联生成,已经获得FDA的批准作为正电子发射计算机断层扫描(PET)的放射性显影剂,用于神经内分泌肿瘤的诊断。诺华(Novartis)开发的放射性配体疗法Lutathera(Lu-177 dotatate)已经获得FDA批准用于治疗生长抑素受体阳性的胃肠胰神经内分泌肿瘤(GEP-NET)患者。该公司的另一款放射性配体疗法Pluvicto(Lu-177 vipivotide tetraxetan)也已获批治疗去势抵抗性前列腺癌患者。
此外,偶联的载荷还可以包括靶向特定信号通路的小分子抑制剂或调节剂,以及包括寡核苷酸和多肽在内的创新生物活性分子。这些不同类型的载荷拓展了偶联药物在癌症治疗、抗感染、以及诊疗一体化方面的应用潜力。
通过合理匹配载荷类型与释放机制,偶联药物可实现在靶点组织的高效积聚与精准杀伤,为多种难治性疾病提供了新的治疗思路。然而,这类疗法复杂的化学合成过程为开发带来了重大挑战。
药明康德在化学业务上的丰富经验为开发这类新一代疗法打下坚实的基础。药明康德旗下WuXi TIDES搭建了独特的CRDMO平台,为全球合作伙伴开发寡核苷酸、多肽药物及相关化学偶联物(TIDES药物)提供高效、灵活和高质量解决方案。在多肽偶联药物开发方面,其全面的多肽平台结合了小分子化学能力,支持多肽-毒素、多肽-金属、多肽-GalNAc、多肽-寡核苷酸和放射性核素偶联药物等偶联药物的开发。WuXi TIDES的一体化平台让多个团队能够并行攻关,密切合作,显著提高项目推进速度。下面的这个案例将展示这一平台如何助力合作伙伴,加速一款环肽-GalNAc偶联药物的研发进程。
一体化平台赋能多肽偶联药物开发
在该案例中,合作伙伴的目标是将一款处于发现阶段的GalNAc偶联环肽药物推进至IND申请。然而,这一过程面临多重挑战:由于药物分子结构复杂,并且合成过程中一个关键多肽中间产物溶解度很低,导致整体产率偏低。同时,合作伙伴以产品的最终商业化为核心目标,这也意味着在早期开发中,如何建立具有成本效益的生产流程成为首要任务之一。
针对这些挑战,WuXi TIDES的原料药(API)和制剂研发与分析团队紧密协作,开展联合攻关。首先要解决的是总产率偏低的问题。研发团队利用WuXi TIDES内部的GalNAc合成能力,采取了一系列质量控制措施,成功解决了GalNAc原料中的关键性杂质问题。团队自行生产的高纯度多肽和GalNAc原料,为提高关键多肽中间产物的溶解度奠定了坚实基础。通过对合成步骤的多重优化,不仅改善了关键多肽中间产物的溶解度,还将总产率从发现阶段的10%提高至20%,提升幅度为100%。凭借多个团队的高效协作,WuXi TIDES仅用12个月便顺利将该药物推进至IND申报阶段。客户对产率的显著提升非常满意,并决定继续与WuXi TIDES团队进行GMP生产合作。
在确保顺利推进的同时,WuXi TIDES团队还致力于降低药物生产成本。他们对GalNAc偶联环肽的生产和纯化流程进行了系统性优化。通过替换昂贵的原材料,使原材料成本降低8%;将关键中间产物的生产步骤由8步缩减为7步,使整体生产成本再降低10%;并利用多柱逆流溶剂梯度纯化(MCSGP)技术,在缩短生产周期的同时进一步降低了成本。最终,凭借这一系列持续优化措施,团队在生产8公斤GMP药物批次时,与生产1公斤GLP药物批次时相比,实现了成本降低71%。
通过兼顾“精准靶向”与“有效治疗”,偶联药物为新药研发带来了全新思路。丰富的配体、连接子与载荷选择不仅提升了组织特异性,还拓展了药物类型与适应症的边界。未来,WuXi TIDES将继续依托其一体化、端到端的CRDMO平台,支持合作伙伴推进偶联药物的研发,助力前沿科技转化为惠及全球患者的突破性疗法。
0人